Würzburg/Braunschweig, 13. Juni 2022 – Freund oder Feind? Mit dieser Frage sehen sich Immunsysteme ständig konfrontiert. Sie müssen Eindringlinge ausfindig machen, ohne der zu schützenden Zelle zu schaden. CRISPR-Cas-Systeme erkennen Fremdkörper anhand ihrer Gen-Sequenz. Doch was passiert, wenn Wirtszellen die gleichen genetischen Merkmale aufweisen? Ein Forschungsteam unter Federführung des Würzburger Helmholtz-Instituts in Kooperation mit der North Carolina State University (USA) hat nun einen Kontrollmechanismus für CRISPR-Systeme mit der Nuklease Cas13 identifiziert: Nur wenn die Menge an Fremd-RNA einen gewissen Schwellenwert übersteigt, lösen die Systeme eine umfassende Immunantwort aus. Diese Erkenntnis eröffnet neue Möglichkeiten für den Einsatz von CRISPR-Cas13 zur Behandlung von Erb- und Infektionskrankheiten. Ihre Ergebnisse haben die Wissenschaftler:innen in der Fachzeitschrift „Cell Host & Microbe“ veröffentlicht.
Fremdkörper vom Wirt zu unterscheiden, ist für Immunsysteme eine große Herausforderung. Erkennen sie einen Eindringling nicht, ist der Wirt einer potenziell tödlichen Infektion ausgesetzt. Stufen sie den Wirt selbst als Fremdkörper ein, kann eine verheerende Autoimmunreaktion die Folge sein. „Für die Behandlung von Infektions-, Erb- und Autoimmunkrankheiten ist es wichtig, zu verstehen, wie Immunsysteme Entscheidungen treffen“, erklärt Chase Beisel, korrespondierender Autor der Studie und Leiter der Abteilung „Synthetische RNA-Biologie“ am Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI) in Würzburg, eines Standorts des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) in Kooperation mit der Julius-Maximilians-Universität (JMU) Würzburg.
Drei goldene Regeln
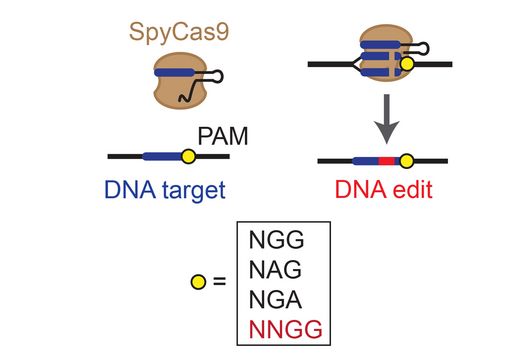
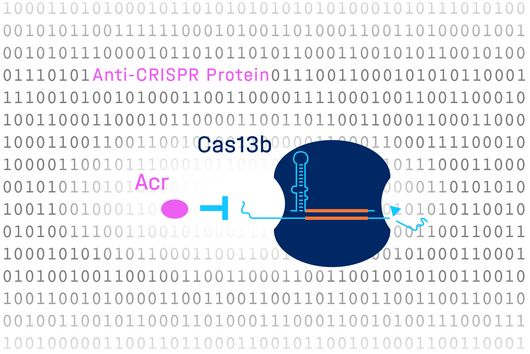
Auch CRISPR-Cas-Abwehrsysteme, die natürlicherweise in Bakterien vorkommen und sie vor viralen Angriffen schützen, müssen regelmäßig entscheiden, ob sie eine Immunantwort auslösen oder nicht. Bei Systemen mit der Nuklease Cas13 äußert sich eine solche Abwehrreaktion in einem umfassenden Abbau von Ribonukleinsäure (RNA, von engl. ribonucleic acid), die Zelle wird in einen Ruhezustand versetzt. In dieser Umgebung kann sich das eindringende Virus nicht weiter vermehren, seine Ausbreitung wird eingedämmt. „Bisher wurde angenommen, dass die Immunreaktion bei CRISPR-Cas13-Systemen ausgelöst wird, sobald zwei Kriterien erfüllt sind: eine Übereinstimmung der Ziel-RNA mit der Leit-RNA des Systems und das Vorhandensein einer zusätzlichen flankierenden Gen-Sequenz“, erklärt Elena Vialetto, Doktorandin am HIRI und Erstautorin der Studie. „Dass auch die Konzentration der Fremd-RNA eine Rolle spielt, war völlig unerwartet“, erläutert sie weiter. Diese zusätzliche „Entscheidungshilfe“ ermöglicht es, zwischen einer akuten und potenziell tödlichen Infektion und einer relativ harmlosen Infektion zu unterscheiden: „Zellen können also entscheiden, inwieweit eine Infektion eine Bedrohung darstellt“, fasst Vialetto zusammen. „Das ist eine bedeutende Erkenntnis, da einige Infektionen auch Vorteile für Bakterien bieten können. Beispielsweise gibt es bestimmte Eindringlinge, die Antibiotikaresistenzgene enthalten und sich nur in das Bakteriengenom integrieren, ohne die Zelle zu töten“, ergänzt Beisel.

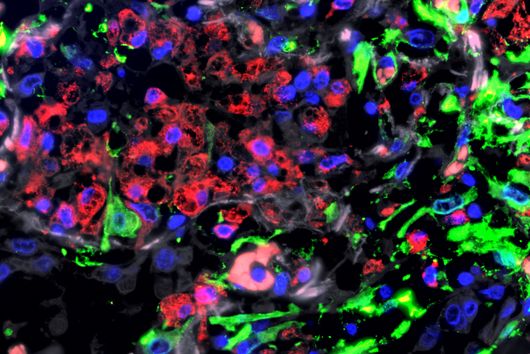
Die Menge an Fremd-RNA beeinflusst die Immunantwort durch CRISPR-Cas13-Systeme – das haben HIRI-Wissenschaftler:innen nun herausgefunden. Bild: HIRI, Elena Vialetto
Neue Möglichkeiten für Therapien und Gen-Abschaltung
Die Nuklease Cas13 hat das Potenzial, künftig bei Virenerkrankungen oder zur Abschaltung unerwünschter Gene eingesetzt zu werden. „Es war immer ein Kuriosum, dass Cas13 in Bakterien durch die Spaltung sämtlicher RNA Ruhezustände auslöst, in menschlichen Zellen jedoch nur die Ziel-RNA spaltet. Unsere Arbeit deutet darauf hin, dass die RNA-Konzentration etwas damit zu tun haben könnte“, bemerkt Vialetto. „Das stellt einen zusätzlichen Faktor dar, der bei der Anwendung von Cas13 zur Abschaltung von Genen berücksichtigt werden muss“, fügt Beisel hinzu. Die Erkenntnisse des Forschungsteams helfen also dabei, die Nuklease besser zu verstehen, und schaffen so die Grundlage für innovative Therapiemöglichkeiten.
In einem nächsten Schritt wollen die Forschenden untersuchen, wie sich dieser Schwellenwert bei anderen CRISPR-Cas-Systeme auswirkt, die RNA erkennen. „Es gibt eine ganze Klasse von Systemen, die so genannten Typ-III-Systeme, die RNA erkennen, dann aber auf andere Proteine angewiesen sind, um die RNA oder DNA zu spalten. Auch hier könnte die RNA-Konzentration einen großen Einfluss darauf haben, wann eine Immunantwort ausgelöst wird und wie das System zwischen gutartigen und gefährlichen Eindringlingen unterscheidet“, gibt Beisel einen Ausblick auf zukünftige Forschungsansätze.
Originalpublikation
A target expression threshold dictates invader defense and prevents autoimmunity by CRISPR-Cas13. Vialetto E, Yu Y, Collins SP, Wandera KG, Barquist L, Beisel CL (2022). Cell Host & Microbe.
Die Studie wurde aus Mitteln der Joint Programming Initiative on Antimicrobial Resistance (JPIAMR), der National Institutes of Health (NIH), des bayerischen Forschungsnetzwerks bayresq.net und im Safe Genes Program der Defense Advanced Research Projects Agency (DARPA) gefördert.

Pressekontakt

































![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/5/4/csm_2024_10_EUREKA__c_HIRI_Luisa_Macharowsky_3_low_01_863006bd0e.jpg)































![[Translate to German:]](/fileadmin/HIRI/__processed__/3/3/csm_2022_07_BEISEL_Chase_2_cropped_Low_a7a341cf03.jpg)





































![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/2/8/csm_Collage_WUE_9fa1cd516c.jpg)










![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/0/8/csm_05_Saliba_02_c_HIRI_Luisa_Macharowsky_ohne_Lacoste_low_zugeschnitten_2_01_9822d73a3f.jpg)






![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/c/c/csm_HIRI-Grundstseinlegung_Foto__c_Mario_Schmitt_79ad64af6d.jpg)













![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/c/2/csm_2023_04_Smyth_Paper_c_HIRI_Luisa_Macharowsky_2_low_84f993d581.jpg)





























![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/e/2/csm_2022_11_HIRI_City_of_Wuerzburg_Child_Care_c_HIRI_Luisa_Macharowsky_2_low_6445b253eb.jpg)
![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/3/9/csm_HIRI_key_visual_CHurtig_606d992d74.jpg)





























![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/f/0/csm_Ahsen_blue2_6e28a4ee6b.jpg)












![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIRI/__processed__/a/5/csm_2022_02_Marco_Olguin_HIRI-Luisa_Macharowsky_04_low_new_3dc837191c.jpg)


![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIRI/__processed__/3/c/csm_Joerg_Vogel_Portrait_-_photocredit_Mario_Schmitt__c__HIRI_5013b9643b.jpg)



![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIRI/__processed__/a/6/csm_RNA_Delivery_1902376336.jpg)
![[Translate to Deutsch:]](/fileadmin/HIRI/__processed__/7/c/csm_Caliskan_Kibe_Pekarek_105c7d1860.jpg)
![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIRI/__processed__/c/1/csm_N-Caliskan_M-Zimmer_Zoom_c93c493293.jpg)